Лекция № 3. Строение и функции белков. Ферменты. Мифы об омолаживающем коллагене: надежды и реальность
Строение белков
Белки представляют собой органические соединения с большой молекулярной массой, состоящие из остатков α-аминокислот.
Белки состоят из углерода, водорода, азота, кислорода и серы. Некоторые белки образуют комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки имеют большую молекулярную массу: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид представляет собой продукт конденсации двух или более аминокислот, связанных между собой пептидной связью.
Пептиды и белки — это одно и то же? Между ними действительно есть сходство, но есть и различия:
-
Основные отличия заключаются в структуре и размере. Белки намного крупнее пептидов. Пептиды состоят из 2-50 аминокислот, а белки состоят из более чем 50 аминокислот.
-
Пептиды менее строго определены по структуре, тогда как белки могут принимать сложные конформации.
-
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Аминокислотный состав белков
Белки представляют собой непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно белковыми мономерами называют 20 типов α-аминокислот, хотя более 170 из них находятся в клетках и тканях.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты – могут синтезироваться; Незаменимые аминокислоты не могут быть синтезированы. Незаменимые аминокислоты необходимо принимать с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава белки бывают: полноценными — содержат весь набор аминокислот; неполные – в составе отсутствуют некоторые аминокислоты. Если белки состоят только из аминокислот, они называются простыми. Если белки, кроме аминокислот, содержат еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеиды).

Все аминокислоты содержат: 1) карбоксильную группу (–COOH), 2) аминогруппу (–NH2), 3) радикал или группу R (остальная часть молекулы). Строение радикала в разных типах аминокислот различно. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие карбоксильную группу и аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе могут действовать как кислоты, так и основания. В водных растворах аминокислоты находятся в различных ионных формах.
Пептидная связь
Пептиды – это органические вещества, состоящие из аминокислотных остатков, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую называют пептидной связью. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т д. Образование пептидной связи может многократно повторяться. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (ее называют N-концом), а на другом конце — свободная карбоксильная группа (ее называют C-концом).

Какие функции выполняют липиды в организме?
Функции липидов в нашем организме зависят от их строения и того, в каком органе они расположены. Липиды «работают» в каждой клетке, чтобы организм мог нормально существовать.
Основные биологические функции липидов:
-
Энергия.
-
Бронировать.
-
Структурный.
-
Ферментативный.
-
Регуляторный.
-
Сигнал.
-
Защита от воды.
-
Теплоизоляция.
Энергетическая
При расщеплении липидов высвобождается энергия. Он используется клетками для обеспечения собственной жизнедеятельности: они дышат, растут, делятся, вырабатывают определенные вещества.
Липиды поступают в цитоплазму клетки с током крови. Когда клетке необходимо пополнить собственную энергию, она расщепляет их и питается высвободившейся энергией.
Запасающая
Эта функция также называется резервным копированием. Каждая ячейка запасает энергию на случай отключения электроэнергии. Энергия запасается в нем в виде жира. За это отвечают адипоциты, которые в основном состоят из капли жира. Адипоциты представляют всю жировую ткань в организме. Максимальное их накопление наблюдается в подкожно-жировой клетчатке и в брюшной полости. Если организм не получает питания, адипоциты распадаются и выступают в роли источника энергии.
Липиды в подкожно-жировой клетчатке отвечают за теплоизоляцию тела. Чем больше их скопление, тем хуже эти ткани проводят тепло. В результате организм имеет возможность поддерживать постоянную температуру тела, не остывает быстро и не перегревается.
Структурная
Липиды образуют двойной слой клеточной стенки, благодаря чему она имеет возможность функционировать и участвовать в обменных процессах. Каждая молекула, образующая эту стенку, состоит из двух частей: одна контактирует с водой (гидрофильная), а другая нет (гидрофобная). Те поверхности молекул, которые взаимодействуют с жидкостью, обращены наружу, а гидрофобные, наоборот, обращены внутрь, практически соприкасаясь друг с другом. Таким образом образуется двойной слой, в толще которого могут располагаться другие вещества, например углеводы или белки.
Отсутствие липидов в клеточной стенке приведет к тому, что она просто потеряет свою форму и правильную структуру.
Ферментативная
Липиды не входят в состав ферментов, но без участия жировых фракций они не могут образовываться.
Липиды играют важную роль в процессе переваривания пищи. Например, желчь содержит значительное количество фосфолипидов и холестерина. Они помогают нейтрализовать избыток ферментов поджелудочной железы, чтобы не повредить кишечник. Липиды из пищи растворяются в желчи, благодаря действию фосфолипидов.
В результате получается, что липиды сами по себе не являются ферментами, но принимают активное участие в их работе. Без них невозможна нормальная работа пищеварительной системы.
Регуляторная
Эта функция для липидов не является самой важной. Непосредственно из крови они не оказывают прямого влияния на различные процессы. В то же время липиды являются составной частью веществ, отвечающих за регуляцию этих процессов. В первую очередь речь идет о гормонах надпочечников и половых гормонах. Без них невозможны работа иммунной системы, нормальный обмен веществ и даже рост и развитие организма в целом.
Липиды входят в состав простагландинов, которые вырабатываются в ответ на воспаление и также влияют на определенные функции нервной системы.
Так что липиды напрямую не влияют на регуляторную функцию, но их недостаток приведет к ряду сбоев в работе организма.
Сигнальная
Некоторые сложные липиды отвечают за сигнальную функцию. Это необходимо для нормального протекания большинства процессов в организме. Таким образом, гликолипиды, содержащиеся в нейронах, обеспечивают нормальную передачу нервных импульсов. Более того, липиды участвуют в передаче сигналов внутри клетки. Они помогают ей идентифицировать вещества, которые попадают в кровь, и пропускают их через мембрану.
Водоотталкивающая
Кожа, шерсть и перья покрыты слоем воска, который делает их эластичными и защищает от влаги. Такой слой воска встречается также на листьях и плодах различных растений.
Теплоизоляционная
Жир обладает низкой теплопроводностью, поэтому образующийся слой сохраняет тепло, позволяя животным жить в холодном климате. У многих животных, обитающих в холодных условиях, он откладывается в значительных количествах. Например, подкожный жир кита может достигать 1 метра
Пространственная организация белковых молекул
Выполнение некоторых специфических функций белков зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно удерживать белки в вытянутом виде, в виде цепи, поэтому полипептидные цепи сворачиваются и приобретают определенную трехмерная структура или конформация. Различают 4 уровня пространственной организации белков.
Первичная структура белка представляет собой последовательность аминокислотных остатков в полипептидной цепи, из которых состоит белковая молекула. Связь между аминокислотами пептидная.

Если белковая молекула состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, различающихся порядком чередования аминокислот, равно 1020. С 20 аминокислотами можно составить еще большее количество различных комбинаций от них. В организме человека обнаружено около десяти тысяч различных белков, отличающихся как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства белковой молекулы и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепи приводит к изменению свойств и функций белка. Например, замена шестой глутаминовой аминокислоты в β-субъединице гемоглобина на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание – серповидноклеточная анемия.
Вторичная структура представляет собой упорядоченное свертывание полипептидной цепи в спираль (похоже на растянутую пружину). Витки спирали укреплены водородными связями между карбоксильными группами и аминогруппами. Почти все группы CO и NH участвуют в образовании водородных связей. Они слабее пептидов, но многократные повторения обеспечивают стабильность и жесткость этой конфигурации. На уровне вторичной структуры находятся белки: фиброин (шелк, ткань), кератин (волосы, ногти), коллаген (сухожилия).



Третичная структура представляет собой укладку полипептидных цепей в сферы, в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в формировании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри сферы, а гидрофильные стремятся появиться на поверхности молекулы в результате гидратации (взаимодействия с диполями воды). В некоторых белках третичная структура стабилизирована ковалентными дисульфидными связями, образующимися между атомами серы двух остатков цистеина. На уровне третичной структуры находятся ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более сферами. Субъединицы удерживаются в молекуле ионными, гидрофобными и электростатическими взаимодействиями. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком с четвертичной структурой является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). Каждая субъединица связана с молекулой гема, содержащей железо.
Если пространственная конформация белков по каким-либо причинам отклоняется от нормы, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губчатой энцефалопатии) является аномальная конформация прионов, поверхностных белков нервных клеток.
Свойства белков
Купить тестовые листы
в биологии




Аминокислотный состав, строение белковой молекулы определяют ее свойства. Белки сочетают в себе основные и кислотные свойства, определяемые аминокислотными радикалами: чем больше в белке кислых аминокислот, тем более выражены его кислотные свойства. Способность отдавать и фиксировать H+ определяет буферные свойства белков; одним из самых мощных буферов является гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть растворимые белки (фибриноген), есть нерастворимые белки, выполняющие механические функции (фиброин, кератин, коллаген). Есть химически активные белки (ферменты), есть химически неактивные, устойчивые к различным условиям внешней среды и крайне неустойчивые.
Внешние факторы (тепло, ультрафиолетовое излучение, тяжелые металлы и их соли, изменение рН, радиация, обезвоживание)
может вызвать нарушение структурной организации белковой молекулы. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называется денатурацией. Причиной денатурации является разрыв связей, стабилизирующих ту или иную структуру белка. Сначала рвутся самые слабые связи, а когда условия ужесточаются, еще сильнее. Поэтому сначала утрачиваются четвертичные, затем третичные и вторичные структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком его биологических функций. Если денатурация не сопровождается разрушением первичной структуры, она может быть обратимой, и в этом случае происходит самовосстановление характерной для белка конформации. Такой денатурации подвергаются, например, мембранные рецепторные белки. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, денатурацию называют необратимой.
Миф о коллагене, нанесенном на кожу
Так что коллаген можно есть, а после расщепления на мелкие части он может стать источником строительных материалов для эндогенного коллагена. А что будет, если на кожу нанести препарат с коллагеном?
Ничего не будет. Молекулы коллагена, как было сказано выше, слишком велики, чтобы их можно было вдавить в кожу, а ферментов для расщепления (как в желудочно-кишечном тракте) на поверхности нет. Таким образом, одним из самых больших мифов в маркетинге средств по уходу за кожей является эффективность коллагеновых продуктов для омоложения кожи. Исследователи предполагают, что некоторые наблюдаемые улучшения состояния кожи при регулярном применении кремов с коллагеном являются результатом увлажнения тканей, и не имеет значения, есть в составе крема коллаген или нет.

Кстати, кремы с добавками коллагена тоже не лечат целлюлит. Но согласно исследованию 2015 года, как минимум шестимесячный курс приема коллагеновых добавок значительно улучшает состояние кожи. Правда, эффект более заметен у женщин с нормальным индексом массы тела, то есть не страдающих ожирением. А вот прекрасным дамам с лишними килограммами подобного эффекта не добиться.
Строение волоса: стержень
В стержне волоса есть три концентрических слоя.

- Продолговатый мозг является центральным мозговым веществом.
Это центральная часть волосяного стержня, которая представлена у человека не во всех типах волос. Например, в пушковых волосах отсутствует сердцевина. Сердцевина заполнена пузырьками воздуха, благодаря чему волосы обладают определенной теплопроводностью. Сердцевина не играет никакой роли в изменении химических или физических свойств волос. - Кора – это корковый слой.
Кора — основное вещество волоса (составляет 80—85% объема), состоит из миллионов кератиновых волокон. Они скручены вместе и соединены прочными поперечными связями. - Кутикула — наружный слой (покровный, чешуйчатый).
Кутикула выполняет защитную, барьерную функцию. Он образован шестью-десятью перекрывающимися слоями прозрачных кератиновых листов, соединенных между собой серией поперечных связей и липидных слоев. Слой оболочки предотвращает механическое и физическое воздействие на волосы. Неповрежденная кутикула хорошо отражает свет; волосы блестящие, эластичные и не ломаются.
Структура и рост волос
Волосы растут примерно на 1-2 сантиметра в месяц. Рост нового волоса начинается с волосяного сосочка, расположенного у основания волосяного фолликула.
Клетки делятся внутри коркового вещества (его образует средняя часть луковицы) — эта зона, расположенная рядом с волосяным сосочком, называется матриксом. По мере продвижения к поверхности кожи головы фолликулярные кератиноциты постепенно теряют свои ядра, уплощаются и ороговевают, заполняясь твердым кератином (ороговевающие). Среди клеток волосяного фолликула также присутствуют меланоциты, определяющие естественный цвет волос. В устье волосяного фолликула проток открывается в сальную железу, содержащую кожное сало — маслянистое вещество, выделяющееся на поверхность кожи волосистой части головы.
Кожное сало вместе с отслоившимися корнеоцитами в эпидермисе и нормальной флорой является основной защитной оболочкой кожи. Кроме того, он смазывает волосы, придавая им эластичность, гладкость и в некоторой степени водостойкость.
Жизненный цикл волоса
Продолжительность жизни волос варьируется от 2 до 5 лет, и этот жизненный цикл состоит из трех этапов. Каждый волосяной фолликул генетически запрограммирован производить примерно 25-27 волос.
Каждая прядь волос живет по своему «индивидуальному графику», и поэтому разные волосы одновременно находятся на разных стадиях жизненного цикла:
- 85% волос находятся в активной фазе роста (анаген);
- 1% в фазе покоя (катаген);
- 14% в стадии потери (телоген).

Анаген представляет собой непрерывное деление клеток матрикса волосяного фолликула, в результате которого новые клетки перемещаются на поверхность кожи волосистой части головы. Этот период активного роста длится 2-5 лет.
Катаген – деление клеток матрикса замедляется и прекращается, волосяной фолликул «засыпает». Волосяная луковица постепенно отделяется от волосяного сосочка. Эта фаза длится очень короткое время – около 1-3 недель.
Телоген – обновление клеток прекращается примерно на 3 месяца (время, когда связь между вновь синтезированным волосяным фолликулом и волосяным сосочком восстанавливается, и новый волос вступает в фазу анагена). Телогеновая луковица, полностью отделившись от кожного сосочка, приобретает вытянутую форму и начинает двигаться к поверхности кожи волосистой части головы. Во время телогенового периода начинают расти новые волосы, а старые выпадают.
Click here to preview your posts with PRO themes ››
На коже головы каждого человека находится в среднем от 100 до 150 тысяч волосяных фолликулов, где формируются, растут и выпадают волосы. Когда вы знаете процент волос в разных фазах, вы можете рассчитать значение, которое характеризует нормальное выпадение волос. В норме мы теряем в среднем 70-80 волос в день.
Аминокислоты и их значение для человеческого организма
Когда мы говорим об аминокислотах, важно учитывать понятие незаменимости. Основным критерием определения биологической ценности аминокислоты является ее способность поддерживать рост человека, что в свою очередь связано с синтезом белка в живом организме.
Незаменимые аминокислоты – это кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для метаболизма и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это приведет к задержке роста и снижению массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты – это те, которые организм может синтезировать самостоятельно или получать из пищи. Это включает:
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их важность:
-
аспартат используется для процессов регенерации;
-
гистидин необходим детям раннего возраста, у которых недостаточный эндогенный синтез;
-
глютамин необходим для регенеративных процессов, важный энергетический субстрат при критических состояниях;
-
таурин необходим новорожденным с недостаточным эндогенным синтезом, а также больным в критических состояниях. Дефицит таурина возникает при недостатке метионина и цистеина;
-
тирозин необходим маленьким детям, у которых недостаточный эндогенный синтез. При сниженной функции почек снижается образование тирозина из фенилаланина;
-
цистеин необходим детям раннего возраста с недостаточным эндогенным синтезом. Дефицит цистеина возникает, когда в рационе недостаточно метионина. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Аминокислоты

Стержень волоса похож по структуре на веревку или скрученный электрический кабель.
- Аминокислоты, которые соединяются друг с другом, образуют полипептидную цепь;
- Полипептидные цепи переплетаются друг с другом, образуя нити;
- Нити, соединяющиеся в несколько частей, образуют протофибриллы;
- Протофибриллы, которые закручиваются друг вокруг друга, образуют макрофибриллы;
- Макрофибриллы образуют основные волокна в коре (корковые слои).
Таким образом, аминокислоты являются строительным материалом для здорового роста волос.
Незаменимые аминокислоты и другие питательные вещества, необходимые для роста волос, попадают в наш организм с пищей. Они разносятся по всему телу кровью и по капиллярам достигают волосяного сосочка. Поэтому путь к здоровым волосам и здоровой коже через правильно сбалансированную диету – это долгий путь.
Миф о коллагене, получаемом с пищей и БАД

Что происходит, когда экзогенный коллаген (извне) или желатин (денатурированный коллаген) попадает в организм человека? 1,4 тысячи аминокислот в каждой из трех цепей — это очень большая молекула. Она не может просто взять и просто просочиться сквозь стенки желудочно-кишечного тракта (ЖКТ).
Поэтому, как и все белки, коллаген при попадании в пищеварительный тракт распадается на отдельные аминокислоты. Это важный момент: аминокислота лизин из расщепленного коллагена ничем не отличается от аминокислоты лизина, попавшей в пищеварительный тракт с молоком, куском мяса или ложкой гороха. Хотя расщепление молекулы коллагена произошло не на отдельные аминокислоты, а на небольшие полипептиды, способные проникать через стенки желудочно-кишечного тракта и идти к костям, мышцам и другим тканям, они полностью утрачивают свой статус «части коллагена» и становятся обычными безличными белками.
Так что неважно, съел человек ложку гидролизованного коллагена, желатина или жевал свиные хрящи – в результате он получит только аминокислоты. Но из них организм при участии витамина С и других веществ будет вырабатывать наш, человеческий, эндогенный коллаген.

Что говорят исследования?
- Употребление добавок с коллагеном повышает эластичность кожи, как и любые продукты, содержащие белки животного происхождения.
- Возрастной распад коллагена приводит к ослаблению и выпадению волос, но доказать, что добавки коллагена останавливают этот процесс, не удалось.
- Коллагеновые добавки никак не влияют на прочность ногтей.
Функции белков
| Строительство | Белки участвуют в формировании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспорт | Белок крови гемоглобин связывает кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносится углекислый газ; В состав клеточных мембран входят особые белки, обеспечивающие активный и строго избирательный перенос определенных веществ и ионов из клетки во внешнюю среду и наоборот. |
| Нормативный | Белковые гормоны участвуют в регуляции метаболических процессов. Например, гормон инсулин регулирует уровень сахара в крови, способствует синтезу гликогена и увеличивает образование жира из углеводов. |
| Защитный | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные их связывать и обезвреживать. Фибрин, образующийся из фибриногена, способствует остановке кровотечения. |
| Двигатель | Сократительные белки актин и миозин вызывают сокращение мышц у многоклеточных животных. |
| Сигнал | Молекулы белков встроены в поверхностную мембрану клетки, способны изменять свою третичную структуру в ответ на действие факторов внешней среды, получая таким образом сигналы из внешней среды и передавая команды в клетку. |
| Бронировать | Как правило, белки в организме животных не запасаются, за исключением яичного альбумина и молочного казеина. Но благодаря белкам в организме некоторые вещества могут запасаться про запас, например при распаде гемоглобина железо не выводится из организма, а запасается и образует комплекс с белком ферритином. |
| Энергия | При расщеплении 1 г белка на конечные продукты выделяется 17,6 кДж. Сначала белки расщепляются до аминокислот, а затем до конечных продуктов – воды, углекислого газа и аммиака. Однако белки используются в качестве источника энергии только тогда, когда другие источники (углеводы и жиры) уже израсходованы. |
| Каталитический | Одна из важнейших функций белков. Обеспечен белками – ферментами, ускоряющими биохимические реакции, протекающие в клетках. Например, рибулозобисфосфаткарбоксилаза катализирует фиксацию СО2 в процессе фотосинтеза. |
Биохимия и метаболизм липидов
Круговорот липидов в организме тесно связан с оборотом других веществ. Пища, которую потребляет человек, состоит из углеводов, белков и жиров. Они должны поступать в определенных пропорциях, только так организм сможет обеспечить себя достаточным количеством энергии. Если баланс нарушен, например, не хватает липидов, то клетки будут расщеплять углеводы и белки, чтобы получить энергию.
Вещества, в обмене которых липиды принимают непосредственное участие:
-
АТФ. Аденозинтрифосфатная кислота присутствует в каждой клетке (принимает участие в их делении, транспорте различных веществ, разрушении токсинов и др.). Для производства требуется энергия, которая высвобождается в процессе расщепления липидов.
-
Нуклеиновые кислоты. Они являются составляющими ДНК, расположенными в ядрах живых клеток. Энергия, высвобождающаяся при распаде липидов, используется для деления клеток. Параллельно происходит образование новой ДНК из нуклеиновых кислот.
-
Стероиды. Эти гормоны содержат много липидов. Если жир из пищи плохо усваивается, у человека могут развиться заболевания эндокринной системы.
-
Аминокислоты. Они входят в структуру белков. В связи с липидами белки превращаются в липопротеины, которые участвуют в процессе транспорта различных веществ в организме.
Липидный обмен:
-
Первой фазой липидного обмена является их переваривание и всасывание. В основном они попадают в организм с пищей. Смешиваясь во рту со слюной, жир начинает расщепляться под действием фермента липазы. Затем они попадают в желудок, где подвергаются дальнейшему разложению под действием соляной кислоты.
-
Липиды не растворяются в воде, поэтому в двенадцатиперстной кишке эмульгируются, после чего расщепляются под действием ферментов поджелудочной железы. Для каждого вида липидов существует свой фермент: холестерин расщепляется холестеринэстеразой, фосфолипиды расщепляются под влиянием фосфолипазы и т д.
-
Всасывание липидов происходит в тонком кишечнике. Их пищеварение — сложный процесс, за который отвечают различные гормоны и им подобные вещества.
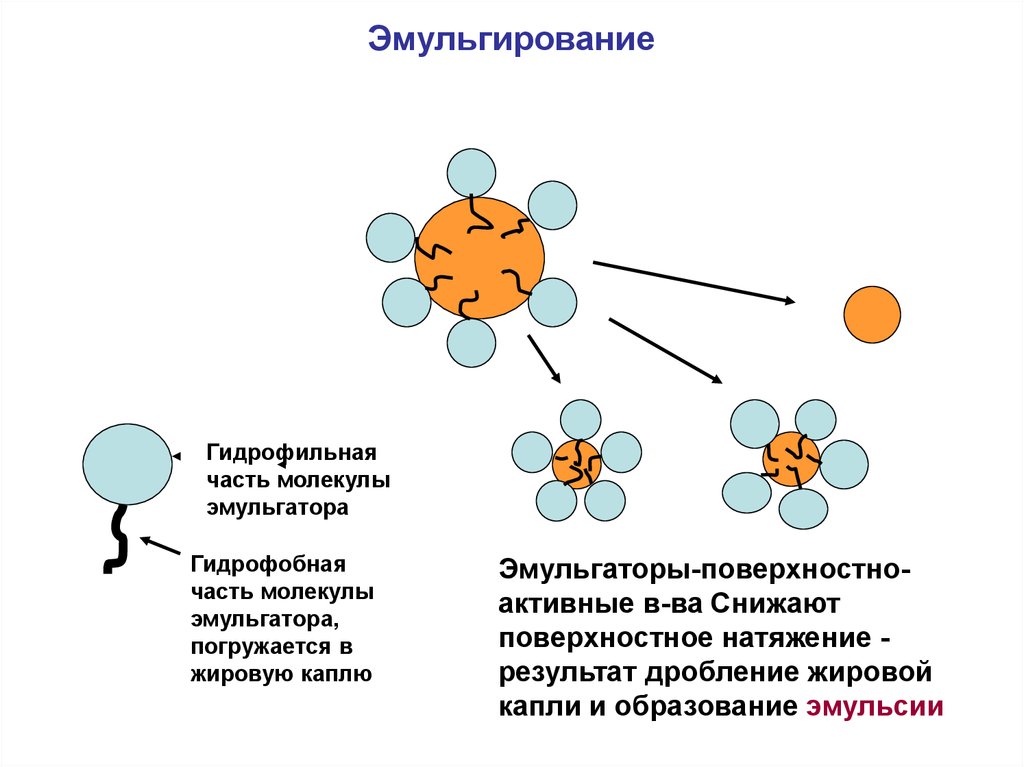
Эмульгирование липидов
Под эмульгированием липидов понимают процесс их неполного растворения в воде.
Когда частично переваренная пища попадает в двенадцатиперстную кишку, жир появляется в виде капель. В таком состоянии ферменты не могут с ними справиться. Эмульгирование направлено на то, чтобы разбить эти крупные капли на мелкие фракции. Площадь соприкосновения капель жира с окружающей водой увеличивается, за счет чего они разделяются.
Стадия эмульгирования липидов:
-
Продукция желчи в печени. Он содержит вещества, отвечающие за дробление крупных капель жира на более мелкие.
-
Скопление желчи в желчном пузыре. Там она получает необходимую концентрацию.
-
Выход концентрированной желчи в двенадцатиперстную кишку. Это происходит, когда в организм попадает пища, содержащая липиды.
-
Эмульгирование жира в двенадцатиперстной кишке. Происходит это под влиянием ферментов поджелудочной железы и активных веществ из желчи.
Если человеку была сделана операция по удалению желчного пузыря, у него будет нарушен процесс расщепления липидов. При этом желчь непрерывно поступает в двенадцатиперстную кишку, непосредственно из печени. Поэтому недостаточно будет эмульгировать жир.
Ферменты, растворяющие липиды
Определенные вещества перевариваются специфическими ферментами. Они разрушают молекулярные связи, существующие между ними, благодаря чему организм получает возможность усваивать их. Липиды расщепляются собственной группой ферментов. В основном они содержатся в соке, вырабатываемом поджелудочной железой. Это включает:
-
Фосфолипаза.
-
Липаза.
-
Холестерин липаза и др.
Связь липидов с витаминами и гормонами
Уровень липидов в крови человека остается стабильным, его небольшие колебания в норме допустимы. Они зависят не только от внутренних, но и от внешних факторов.
Несколько веществ отвечают за поддержание уровня липидов в крови, в том числе:
-
Ферменты поджелудочной железы. Они участвуют в расщеплении липидов, поступающих в организм с пищей. Если выработка панкреатического сока нарушена, кишечник не сможет всасывать липиды. В результате они просто покинут организм и уровень снизится.
-
Соли и желчные кислоты. Они принимают непосредственное участие в эмульгировании липидов. Без них они не смогут всосаться в стенку кишечника.
-
Гормоны. Они в целом влияют на обменные процессы, происходящие в организме. Например, избыток инсулина приводит к изменению уровня липидов. В связи с этим для больных сахарным диабетом разработаны собственные показатели нормы и патологии. Гормоны, такие как норадреналин и глюкокортикостероиды, помогают уменьшить количество липидов в организме.
-
Ферменты, содержащиеся в клетках кишечника. Они отвечают за превращение липидов в транспортную форму и перенаправление их в системный кровоток.
-
Витамины. Они оказывают прямое и косвенное влияние на липидный обмен. Например, при недостатке витамина А клетки слизистых оболочек хуже регенерируют, что негативно сказывается на функции пищеварительного тракта.
Чтобы уровень липидов не выходил за пределы нормы, необходима правильная работа всего организма в целом. Имеет значение гормональный баланс, поступление достаточного количества витаминов с пищей. Поджелудочная железа и кишечник должны быть здоровыми, чтобы обеспечить организм необходимыми ферментами.
Процесс образования и распада липидов
Метаболические процессы бывают двух типов: катаболические и анаболические. Катаболизм — это расщепление веществ, а для липидов — гидролиз, то есть их расщепление на простые молекулы. Анаболизм – это образование новых веществ.
Ткани и клетки, в которых происходит образование липидов:
-
Эпителий кишечника. В стенах они поглощаются и там превращаются в формы транспорта. С током крови преобразованные молекулы доставляются в печень.
-
Печень. В паренхиме органа происходит расщепление липидов и образование на их основе новых веществ. Например, холестерин связывается с фосфолипидами, которые попадают в желчь и обеспечивают нормальную работу пищеварительного тракта.
-
Клетки различных органов. С током крови молекулы жирных кислот попадают не только в печень. Они разносятся по всему организму, когда проникают в мембраны всех клеточных стенок, образуя в них липидный слой. Половые железы и надпочечники используют липиды для производства стероидных гормонов.
Все описанные процессы тесно связаны друг с другом и составляют обмен липидов в организме.
Ресинтез липидов
Ресинтез липидов предполагает их расщепление на простые вещества, от которых организм может получить максимальную пользу. После пассажа экзогенные липиды становятся эндогенными. Этот процесс также использует энергию.
Во-первых, липиды ресинтезируются в кишечнике, когда жирные кислоты из пищи превращаются в транспортные формы. Попадая в печень, они проходят вторую стадию ресинтеза и превращаются в вещества, обеспечивающие работу пищеварительной системы. Часть липидов направляется в клетки внутренних органов, которые используют их для удовлетворения собственных нужд. Неиспользованные липиды откладываются в виде жировых запасов.
Ферменты
Ферменты, или энзимы, представляют собой особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) превышает скорость реакций с участием неорганических катализаторов. Вещество, на которое действует фермент, называется субстратом.
Ферменты представляют собой глобулярные белки; по своим структурным свойствам ферменты можно разделить на две группы: простые и сложные. Простые ферменты представляют собой простые белки, т.е состоят только из аминокислот. Сложные ферменты представляют собой сложные белки, т е в их составе, кроме белковой части, имеется группа небелкового характера — кофактор. Кофакторами некоторых ферментов являются витамины. В молекуле фермента выделяется особая часть, называемая активным центром. Активный центр представляет собой небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. После завершения реакции фермент-субстратный комплекс распадается на фермент и продукт(ы) реакции. Некоторые ферменты имеют (помимо активных) аллостерические центры — места, к которым прикрепляются регуляторы скорости фермента (аллостерические ферменты).

Реакции ферментативного катализа характеризуются: 1) высокой эффективностью, 2) строгой избирательностью и направленностью действия, 3) субстратной специфичностью, 4) тонкой и точной регуляцией. Субстратность и реакционная специфичность реакций ферментативного катализа объясняется гипотезами Э. Фишера (1890) и Д. Кошланда (1959.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивают с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «ручной перчатки») предположил, что пространственное соответствие между структурой субстрата и активным центром фермента создается только в момент их взаимодействия друг с другом. Эту гипотезу также называют гипотезой индуцированной адаптации.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, их активность наиболее высока в физиологически нормальных условиях.
Большинство ферментов могут работать только при температуре от 0 до 40°C. В этих пределах скорость реакции увеличивается примерно на 2 раза на каждые 10°С повышения температуры. При температуре выше 40 °С происходит денатурация белка и снижение активности фермента. При температурах, близких к температуре замерзания, ферменты инактивируются.
С увеличением количества субстрата скорость ферментативной реакции увеличивается до тех пор, пока число молекул субстрата не сравняется с числом молекул фермента. При дальнейшем увеличении количества субстрата скорость возрастать не будет, так как активные центры фермента насыщаются. Увеличение концентрации фермента приводит к увеличению каталитической активности, так как большее число молекул субстрата претерпевает превращения в единицу времени.

Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или более низких значениях рН активность фермента снижается. При резких изменениях рН фермент денатурирует.
Скорость аллостерических ферментов регулируется веществами, которые прикрепляются к аллостерическим центрам. Если эти вещества ускоряют реакцию, их называют активаторами; если они замедляются, их называют ингибиторами.

[spoiler title=»Источники»]
- https://licey.net/free/6-biologiya/21-lekcii_po_obschei_biologii/stages/257-lekciya_3_stro
- https://skysmart.ru/articles/chemistry/himicheskij-sostav-belkov
- https://www.ayzdorov.ru/ttermini_lipidy.php
- https://MedAboutMe.ru/articles/mify_o_tselebnom_kollagene_nadezhdy_i_realnost/
- https://clinicaveka.ru/publications/stroenie-volosa.html
[/spoiler]





